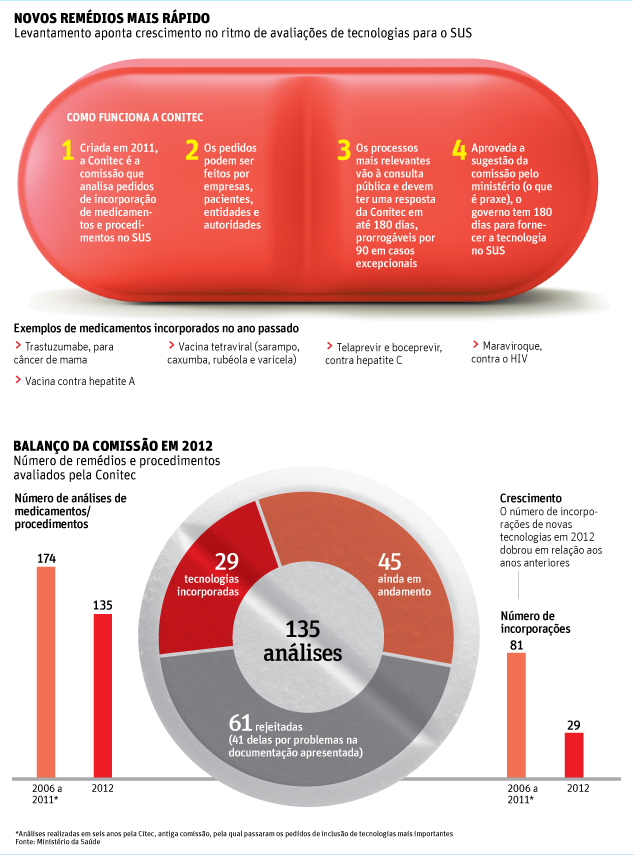
Após a confirmação de quatro mortes ligadas ao uso da pílula Diane 35, um remédio para a acne amplamente receitado como contraceptivo, as autoridades sanitárias da França decidiram interromper sua comercialização.
A proibição começa a valer daqui a três meses, mas os médicos já devem parar de receitar a pílula.
A agência, no entanto, desaconselhou a interrupção abrupta para quem está usando a medicação. A orientação é para que as mulheres francesas visitem um médico para trocá-la por uma das várias alternativas disponíveis no mercado.
A suspensão vale também para os genéricos do medicamento, que é uma combinação de acetato de ciproterona e etinilestradiol.
No Brasil, a Anvisa (Agência Nacional de Vigilância Sanitária) disse estar acompanhando o caso, mas, até agora, não há nenhuma alteração em relação ao uso do medicamento em vista.
As autoridades francesas pediram ainda que a EMA (Agência Europeia de Medicamentos) conduza uma ampla investigação sobre o uso e as possíveis complicações da Diane 35 no continente.
OS CASOS
Um relatório da agência francesa divulgado recentemente indicou que, nos últimos 25 anos, o uso de Diane 35 esteve relacionado a quatro mortes e a mais de uma centena de complicações graves, como trombose venosa profunda, embolia e AVC (Acidente Vascular Cerebral).
Embora o medicamento seja aprovado na França e em muitos países, inclusive no Brasil, como remédio para a acne, ele é amplamente receitado como contraceptivo.
"O uso de Diane 35 como contraceptivo já é consagrado e amplamente descrito na literatura médica", diz Marta Franco Finotti, presidente da Comissão Nacional Especializada em Anticoncepção da Febrasgo (Federação Brasileira das Associações de Ginecologia e Obstetrícia).
Segundo Finotti, não há motivo para pânico.
"Não existe nenhuma evidência nova de perigo. Um possível aumento de problemas cardiovasculares já é conhecido. Por isso, é importante que o médico, antes de prescrever a medicação, avalie outros fatores de risco."
Na França, a pílula tem cerca de 315 mil usuárias. A representante da Febrasgo estima que 1,5 milhão de mulheres usem Diane 35 ou seus genéricos no Brasil.
A multinacional alemã Bayer, que fabrica a pílula, não confirma esses números.
OUTRO LADO
Em nota, a farmacêutica afirmou que vai cooperar com as autoridades francesas, mas diz que, até agora, não tomou conhecimento de qualquer novo fato que "leve a uma mudança na avaliação positiva do risco-benefício do Diane 35".
No início da semana, a Bayer reafirmou que o remédio é destinado ao tratamento da acne, "não sendo indicado com um método de contraceptivo oral".
A empresa afirma que os riscos de ocorrência de problemas cardiovasculares nas usuárias estão claramente descritos na bula.
NOVAS PÍLULAS
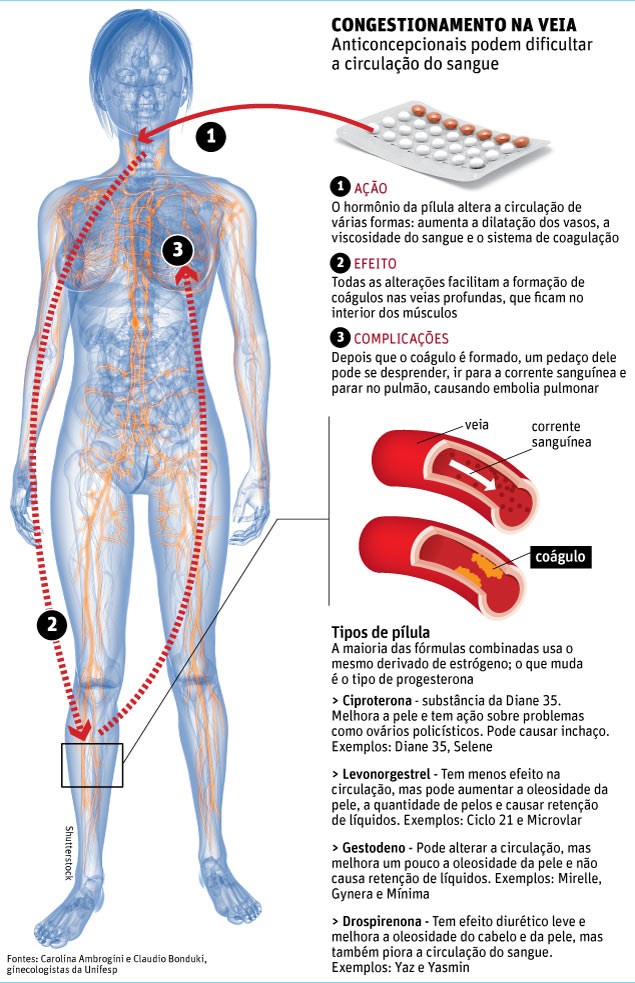
A associação entre contraceptivos hormonais e complicações cardiovasculares é antiga e conhecida.
No entanto, as chamadas pílulas de nova geração, posteriores à Diane 35 e que têm baixa concentração de hormônios, além de também melhorarem a pele, estão na mira das agências regulatórias.
Estudos recentes mostraram que essas pílulas com drospirenona, como a Yasmin e a Yaz, também da Bayer, aumentam o risco de formação de coágulos sanguíneos.
A FDA (agência que regula alimentos e remédios nos EUA) discutiu amplamente o tema em 2011 e acabou decidindo manter essas pílulas no mercado, mas com advertências nas bulas sobre riscos aumentados.
Agora, é a EMA, a agência reguladora europeia, que está conduzindo um estudo sobre os riscos.
"Não há contraceptivo hormonal 100% seguro. Mas, na maioria dos casos, a chance de complicações é baixíssima", afirma Carlos Alberto Petta, professor de ginecologia da Unicamp.
Segundo ele, antes de receitar um contraceptivo, o médico deve fazer uma avaliação criteriosa do histórico de saúde e de possíveis outros fatores de risco.
"Tabagismo, obesidade, sedentarismo e a questão da idade também devem ser considerados."
| Editoria de Arte/Folhapress | ||
 |